|
藥事法部分條文修正草案已於11月17日經立法院三讀通過,除全面提高罰則,加重藥商責任外,並增訂建立藥品追蹤追溯機制、必要藥品供應不足之通報、提供藥品資訊易讀性之輔助措施、因應緊急需求等藥物製造或輸入專案核准機制、藥品原料藥來源管理等攸關保障民眾用藥需求之相關條文,使藥政管理更符合實務需求。
食藥署表示,此次藥事法修正反映民眾用藥的實務需求,食藥署已著手依修正後的藥事法研擬相關子法規與各項配套措施,使藥物管理制度更臻完備。
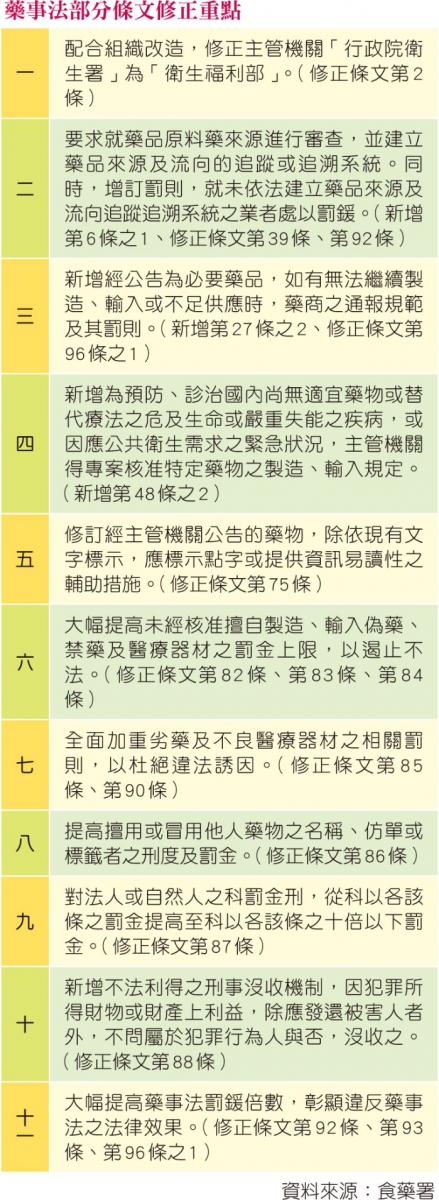
立法院第8屆第8會期第9次會議通過,增訂藥事法第六條之一、第二十七條之二及第四十八條之二條文;並修正第二條、第三十九條、第七十五條、第八十二條至第八十八條、第九十條、第九十二條、第九十三條及第九十六條之一條文。
食藥署說明此次藥事法部分條文修正之六大重點:
一、建立藥品追蹤追溯機制,可快速追溯藥品源頭產製資訊,或掌握違規產品流向:經公告之藥品類別,藥商應依其產業模式建立藥品之追蹤或追溯系統;中央衛生主管機關應建立前項追蹤或追溯電子申報系統並訂定相關子法規。
二、建立必要藥品供應不足之通報機制,以利衛生機關及早評估因應措施:經中央衛生主管機關公告之必要藥品,如有無法繼續製造、輸入或不足供應之虞時,藥商應至少於六個月前向中央衛生主管機關通報並登錄於公開網站,中央衛生主管機關並得專案核准該藥品或其替代藥品之製造或輸入,以資改善藥品供應不足問題。
三、提供藥物資訊易讀性之輔助措施:經中央衛生主管機關公告之藥物,其標籤、仿單或包裝,應提供點字或其他足以提供資訊易讀性之輔助措施,以利弱勢族群讀取藥品資訊。
四、因應緊急需求之專案核准機制:為預防、診治危及生命或嚴重失能之疾病,且國內尚無適當藥物或合適替代療法,或為因應緊急公共衛生情事之需要,中央衛生主管機關得專案核准特定藥物之製造或輸入。
五、大幅提高罰則,以提高藥商責任並遏阻不法:例如製造或輸入偽藥或禁藥者,其罰則由「處十年以下有期徒刑,得併科新臺幣一千萬元以下罰金」提高為「處十年以下有期徒刑,得併科新臺幣一億元以下罰金」;藥品所含有效成分之質、量或強度,與核准不符者,罰鍰由「六至三十萬」提高至「十至五千萬」;增訂不法利得及沒收之規定,犯藥事法之罪者,因犯罪所得財物或財產上利益,除應發還被害人外,不問屬於犯罪行為人與否,沒收之。
六、將原料藥來源明文納入藥品查驗登記審查範圍。
|